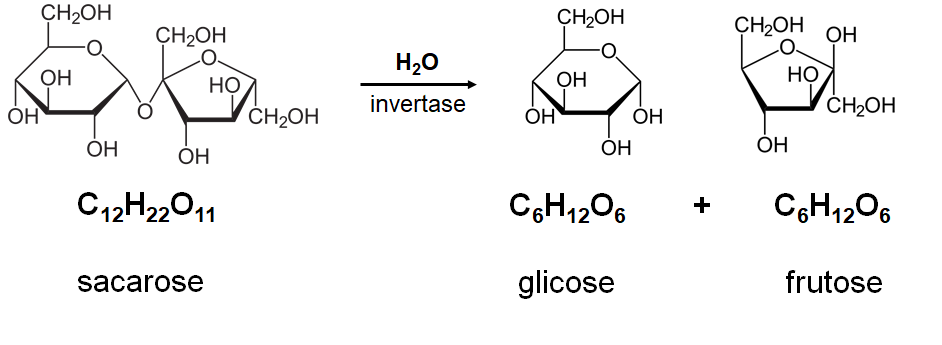
Apesar do histórico de exclusão, discriminação e invisibilidade na sociedade, a mulher por meio de suas concepções, anseios e percepção do mundo, vem alcançando novos patamares no meio social. As mulheres hoje frequentam os mais diversos espaços acadêmicos, e ao longo do tempo vêm produzindo conhecimento, apesar de muitas ainda serem mantidas na invisibilidade.
Neste artigo evidencia-se a importância da figura feminina na Ciência. Para tanto, ressaltamos a figura e genialidade de Marie Curie, considerada o maior ícone feminino da história da Ciência.
Marie Sklodowska nasceu em 7 de novembro de 1867 em Varsóvia na Polônia. Era filha de um casal de professores que à época lutava pela independência polonesa e sofria muita represália do governo Russo. Dentre as proibições impostas, havia a impossibilidade de mulheres ingressarem no ensino superior. Marie estudou em uma escola para mulheres, e ao se formar, mudou-se para Paris, com o objetivo de se formar em Ciências.
Em 1891, Marie ingressava na Universidade de Sorbonne onde obteve o título de bacharel em Física e um ano depois conclui o bacharelado em Matemática. Na França, Marie foi apresentada ao físico francês Pierre Curie, o encontro mudaria não apenas as vidas dos dois, mas o curso da Ciência, pois, para além das pesquisas, o casal se apaixonou e em 1985 se casaram.
Juntamente com Pierre e o físico Henri Becquerel, Marie Curie conduziu pesquisas acerca da fluorescência e fosforescência de sais de urânio, as quais levaram ao descobrimento da radioatividade, o que rendeu ao trio o Prêmio Nobel de Física de 1903.
Fonte: https://www.bbc.com/portuguese/internacional-43092590
O casal Curie mais tarde veio a descobrir dois novos elementos químicos, o rádio e o polônio. Uma mulher cientista e polonesa, fazendo descobertas que mudaram o rumo da história, era algo difícil de ser aceito pelos homens da época. Contudo, Marie comprovou a existência do elemento polônio, cujo nome foi dado em homenagem a sua terra natal. Posteriormente, as pesquisas do casal os levaram à descoberta de mais um elemento químico, ao qual deram o nome de rádio.
Em 1906, quando do falecimento de Pierre, Marie assume então a cadeira de Física do marido na Universidade de Sorbonne, tornando-se a primeira mulher a lecionar nesta universidade. Em 1911, Marie foi novamente agraciada com o Prêmio Nobel, desta vez na área da Química, pela descoberta dos elementos polônio e rádio.
Marie Curie permanece até hoje como sendo a única pessoa a ganhar dois Prêmios Nobel em áreas diferentes. Aquela que por muito tempo foi alvo de preconceito e até mesmo de agressões no meio científico, através de suas descobertas mudou o panorama da Ciência e também da medicina, já que durante a Primeira Guerra Mundial ela criou um micro aparelho de raio-X móvel e foi para a linha de frente trabalhar com médicos e enfermeiros no atendimento de soldados feridos.
Marie Curie treinando profissionais da saúde durante a Primeira Guerra Mundial. Fonte: https://www.bbvaopenmind.com/en/science/leading-figures/the-great-invention-of-marie-curie
Por tantos feitos pela humanidade, Marie passou a ser reconhecida e respeitada por todos. Suas descobertas tiveram alto custo para sua saúde, vindo a falecer em 1934 após um quadro de leucemia, devido a sua exposição maciça à radiação durante o trabalho como cientista.
Marie Curie com sua genialidade e ousadia enfrentou preconceitos em uma época em que a mulher não tinha vez, não tinha voz, conseguindo com seus feitos científicos revolucionar as mais diversas áreas da Ciência, Medicina e Tecnologia, dando às mulheres uma nova identidade, a de ser humano capaz, independente do seu gênero.
Por Anna Elisa Salgado Oliveira; Bianca Jaqueline Alves Serapião; Maraisa Soares dos Santos; Jordana Geralda Ferreira; Alda Ernestina dos Santos (alda.santos@ifmg.edu.br)